Der Zelltod als Indikator für toxische Wirkungen
An der Schnittstelle zwischen Grundlagenforschung und regulatorischer Toxikologie arbeitet die Arbeitsgruppe von Prof. Dr. Marcel Leist. Seine Professur für In vitro Toxikologie und Biomedizin wurde ursprünglich von der Doerenkamp-Zbinden-Stiftung finanziert, um das Forschungsgebiet der Alternativmethoden zum Tierversuch zu stärken. Leist ist außerdem Co-Direktor des Center for Alternatives to Animal Testing in Europe (CAAT-Europe), einem Joint Venture mit der Bloomberg School of Public Health (Johns Hopkins University, Baltimore), das lokale und transatlantische Bemühungen zur Entwicklungen von innovativen, tierversuchsfreien Testmethoden in der Toxikologie koordiniert. Für sein Lebenswerk auf diesem Gebiet ist Marcel Leist gemeinsam mit Thomas Hartung von der Johns Hopkins Bloomberg School of Public Health mit dem Ursula M. Händel-Tierschutzpreis der Deutschen Forschungsgemeinschaft (DFG) ausgezeichnet worden.
Das Hauptinteresse der AG Leist besteht darin, toxische Effekte besser zu erfassen und vorherzusagen. Zu diesem Zweck entwickelt sie unter anderem neue Testmethoden, die auf menschlichen Zellen basieren und somit ohne Tierversuche auskommen. Insbesondere der programmierte Zelltod ist für Leist und seine MitarbeiterInnen interessant, da die mit der Apoptose zusammenhängenden Zellmarker auch Rückschlüsse auf bestimmte toxische Wirkungen zulassen. So kann beispielsweise schon allein die Tatsache, dass ein Zelltodprogramm abläuft, darauf hinweisen, dass eine toxische Wirkung stattgefunden hat.
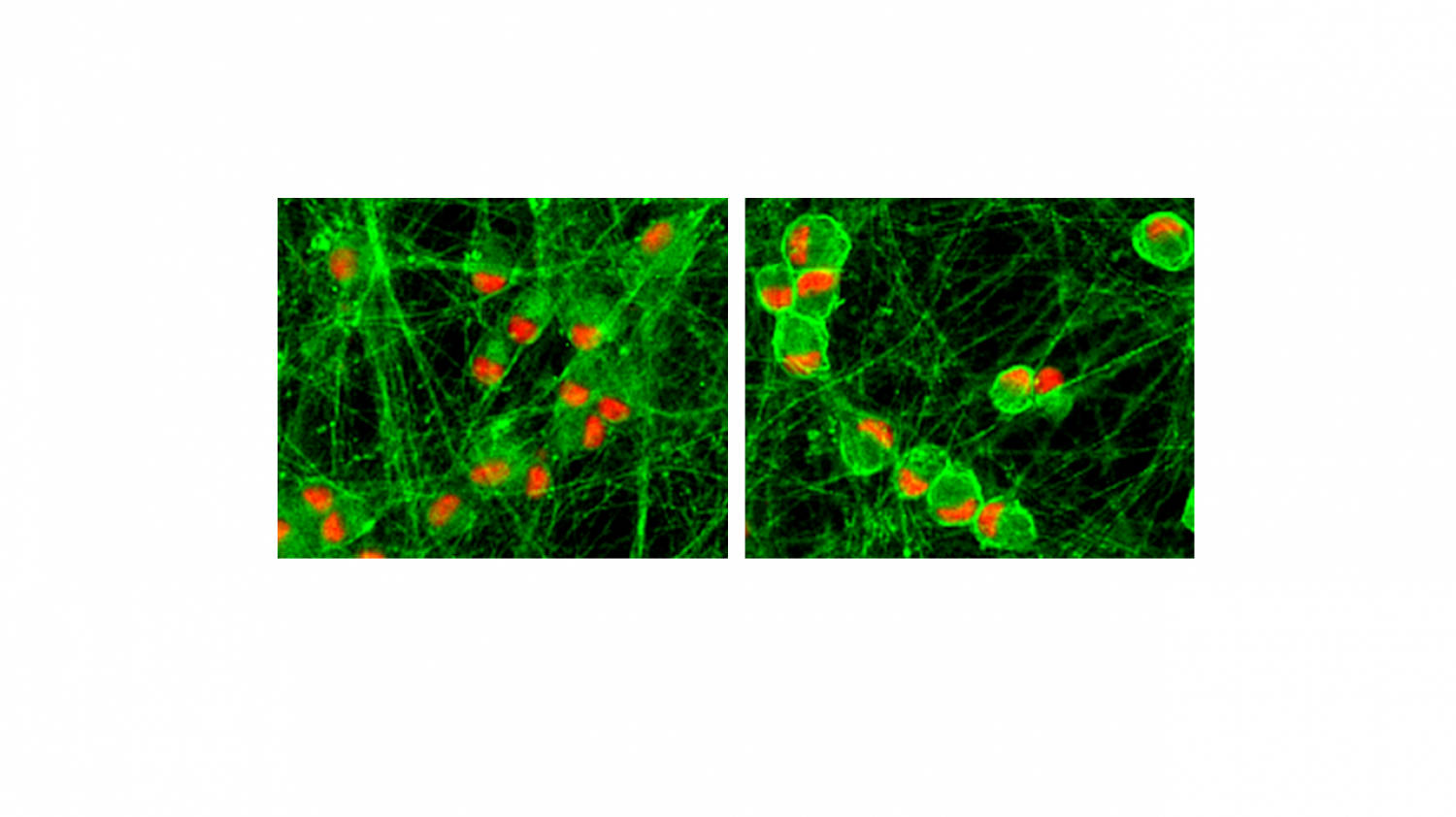
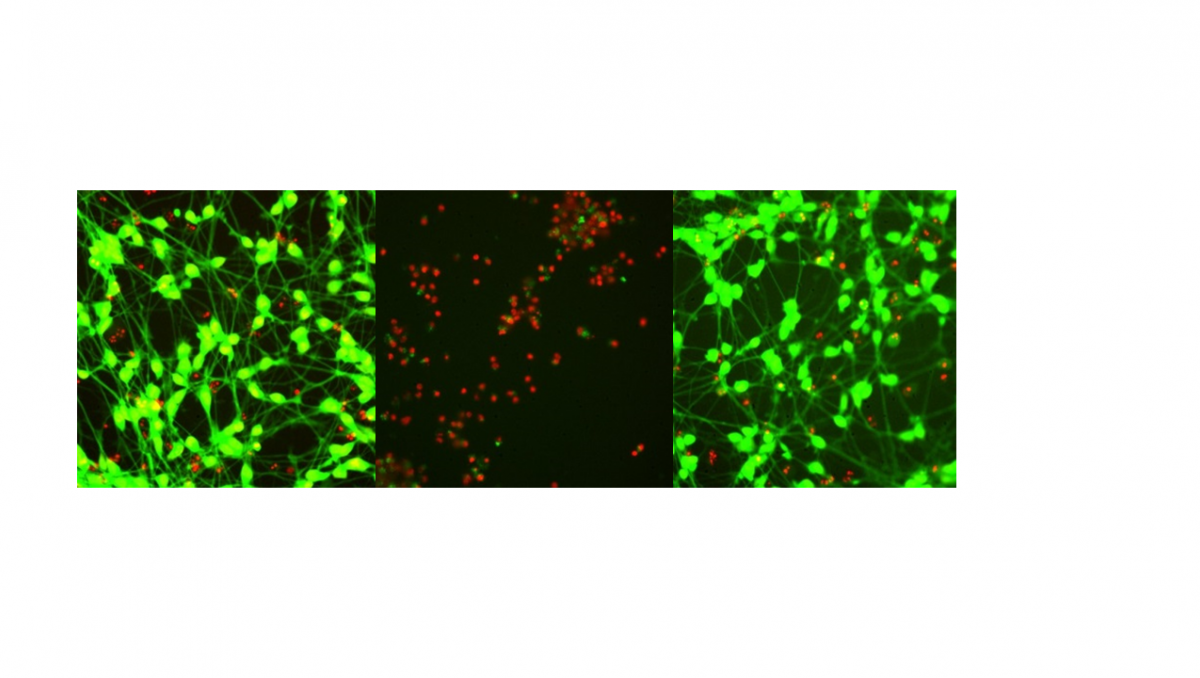 Links: lebende neuronale Kulturen (grüne Färbung = lebende Zellen); Mitte: tote neuronale Kultur nach der Behandlung mit einem Gift (rote Färbung = tote Zellen); Rechts: lebende Kultur, nach Behandlung mit einem Giftstoff und einem antineurodegenerativen Medikament
Links: lebende neuronale Kulturen (grüne Färbung = lebende Zellen); Mitte: tote neuronale Kultur nach der Behandlung mit einem Gift (rote Färbung = tote Zellen); Rechts: lebende Kultur, nach Behandlung mit einem Giftstoff und einem antineurodegenerativen Medikament
Besonders problematisch wird es, wenn Substanzen Zelltodprogramme auslösen, die denen typischer Krankheiten ähneln. So gibt es Pestizide, die durch diesen Mechanismus die gleichen Symptome auslösen, wie bei der Parkinson-Erkrankung. Das Team um Marcel Leist versucht unter anderem zu verstehen, welche Signalprozesse ein Pestizid in der Zelle auslöst und wie sich diese aufhalten oder unterbrechen lassen: „Verstehen wir die zugrundeliegenden Prozesse, können wir Medikamente einsetzen, die den Zelltod verhindern, selbst wenn ein Pestizid auf den Körper einwirkt“, so der Wissenschaftler. Er hat sich mit seiner Arbeitsgruppe auf das menschliche Nervensystem und Gehirn spezialisiert und erforscht das Phänomen des programmierten Zelltods bei Neuriten, den Ausläufern der Nervenzellen, die bei Chemotherapien besonders betroffen sind (siehe auch „Zelltod durch Strahlen- und Chemotherapie – Zwei Seiten einer Medaille“).
Normale Zellen sind rundlich und sterben ab, wenn das Zelltodprogramm ausgelöst wird. Bei Nervenzellen, zu denen auch solche gehören, die für das Gefühl in den Fingerspitzen verantwortlich sind, befindet sich der eigentliche Zellkörper im Rückenmark, während sich die teilweise meterlangen Ausläufer oder Neuriten von dort durch den ganzen Körper ziehen. Auch bei solch großen Nervenzellen kann der programmierte Zelltod auftreten, ist allerdings aufgrund der Größe der Zellen auf einen Teil davon beschränkt. „Bei peripheren, also nicht im Gehirn auftretenden Neuropathien sterben nur die Neuriten ab“, erklärt Leist. „Das führt zu Gefühlsverlust oder Phantomschmerzen und tritt bei manchen Chemotherapien in bis zu 90 Prozent der Fälle als Nebenwirkung auf. Uns interessiert, wie es sein kann, dass ein Teil der Zelle stirbt, während der Nervenkörper erhalten bleibt. Könnten wir dieses spezielle Zelltodprogramm aufhalten, würde das eine enorme Erleichterung für Patientinnen und Patienten in der Chemotherapie bedeuten.“
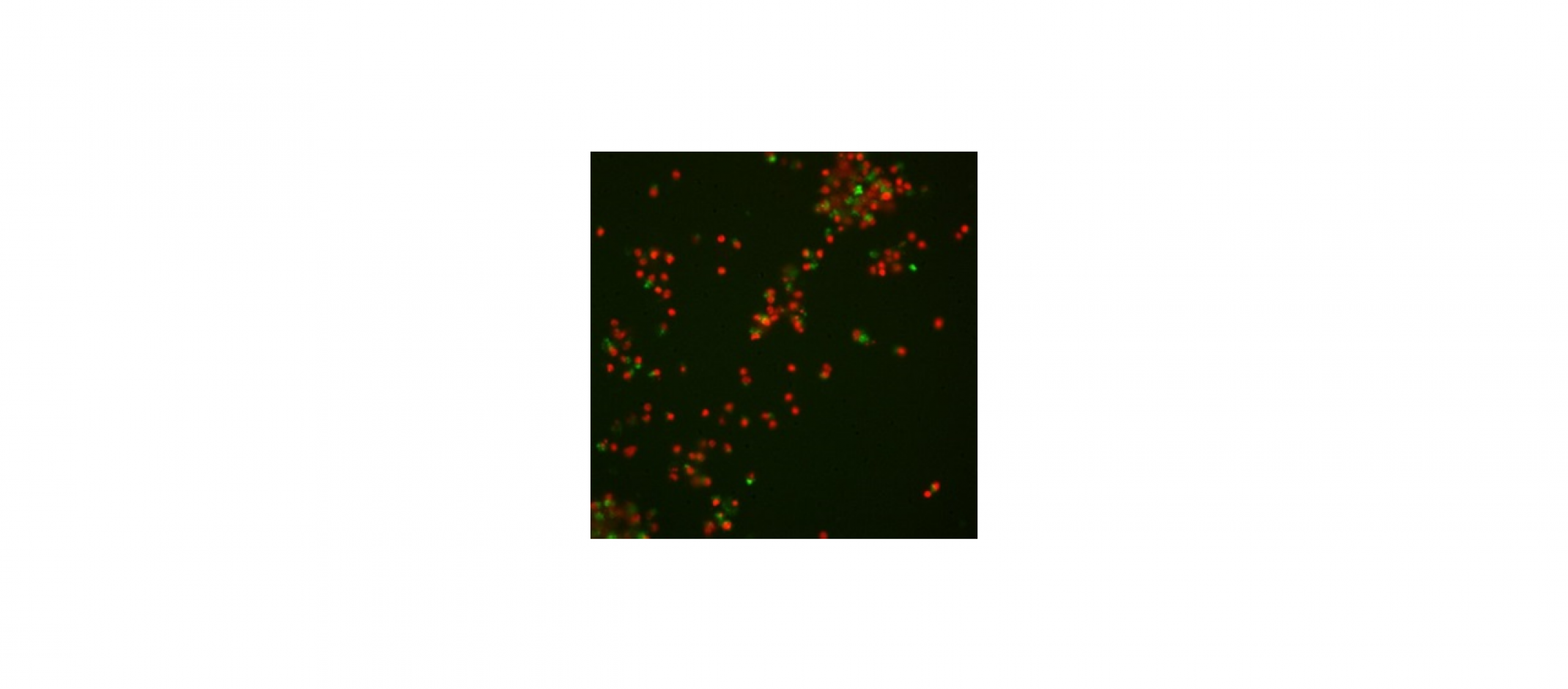
Menschliche sensorische Neuronen
Links: Grün gefärbte Kontrollzellen mit rot gefärbtem Zellkern
Rechts: Frühes Stadium des chemotherapie-assoziierten Zelltodes: Die Neuriten gehen verloren, sie verdichten sich zu Ringen um den Zellkörper, und die DNA-Struktur verdichtet sich und wird bohnenförmig.
Auch hier ist die Frage entscheidend, ob und inwiefern das Zelltodprogramm einer Tumorzelle sich von dem Programm unterscheidet, das in den Neuriten abläuft. Leist sagt: „Können wir diese Unterschiede verstehen, können wir entsprechende Verfahren entwickeln und einsetzen, die Tumorzellen töten, die Neuriten jedoch unversehrt lassen.“ Da es sehr viele Gene und Signalwege gibt, die an der Apoptose beteiligt sind, besteht die Chance, das „Selbstzerstörungsprogramm“ der Zelle unterschiedlich zu triggern. So ist bei der Kinderleukämie eine gezielte Abtötung der Krebszellen bereits möglich, ohne dass weitere Schäden an gesunden Zellen entstehen. Bei vielen Krebsvarianten und Therapieansätzen ist das aber nach wie vor ein Problem.
Leist arbeitet an der Erforschung von Neuropathien mit menschlichen Zellen. „In den 1930er bzw. 1940er Jahren kamen Maus- oder Rattenmodelle auf und man fand heraus, dass Tests an Tieren auch Rückschlüsse auf den Menschen zulassen. Diesem Ansatz folgten Zellkulturen, die zunächst aus Mäusen oder Ratten gewonnen wurden, später auch aus menschlichen Tumorzellen. Das eigentliche Interesse gilt aber natürlich dem gesunden Gewebe, und hier hat die Stammzellforschung den entscheidenden Unterschied gemacht“, berichtet Leist. So war sein Labor das erste Labor in Süddeutschland, das mit embryonalen Stammzellen arbeiten durfte.

„Das war ein Türöffner, denn aus embryonalen Stammzellen lassen sich menschliche Nervenzellen erzeugen.“
Prof. Dr. Marcel Leist, In-Vitro-Toxikologie und Biomedizin
Inzwischen ist dieser Ansatz – die Arbeit mit menschlichen Stammzellen – auch unter ethischen Gesichtspunkten unproblematisch, denn diese können mittlerweile auch nicht-embryonal erzeugt werden, beispielsweise aus Hautzellen: „Das funktioniert so gut, dass sich aus einer einzigen Hautzelle einer Maus eine ganz neue, lebende Maus züchten lässt“, so der Wissenschaftler. „Das Problem, mit dem wir konfrontiert waren, besteht darin, dass es keine Möglichkeit gibt, aus dem Menschen heraus an diese langen Nervenzellen heranzukommen. Da diese auch schon einmal über einen Meter lang werden können, könnte man sie vermutlich nicht einmal aus einem toten Körper entfernen. Die Laborzüchtung eröffnet uns hier Forschungsmöglichkeiten, die noch vor Jahren undenkbar waren.“
Ebenso wie die Arbeitsgruppen von Prof. Dr. Thomas Brunner (siehe „Der Zelltod als Krankheitsbeschleuniger“) und Prof. Dr. Daniel Dietrich (siehe „Risiken abschätzen und minimieren“) arbeitet auch Marcel Leist mit 3D-Zellkulturen, die im Gegensatz zu 2D-Kulturen die Dreidimensionalität von Gewebe berücksichtigen. In 3D-Kulturen besitzen die gezüchteten Zellen eine räumliche Orientierung, so, wie das auch im lebenden Körper der Fall ist. Während sich Brunner und Dietrich auf 3D-Darm- respektive Nierenkulturen spezialisiert haben, arbeitet Leist mit 3D-Kulturen von Nervengewebe. Teilweise ist es bereits möglich, in diese künstlich erzeugten, gewebsartigen Zellverbände Blutgefäße einzuführen. Durch die daraus resultierenden Organoidstrukturen entsteht aktuell ein neuer Forschungszweig, der die Zellforschung näher an den Menschen heranbringt und der Wissenschaft neue Möglichkeiten bei der Testung auf Infektionen oder der Erprobung von neuen Arzneimitteln eröffnet.
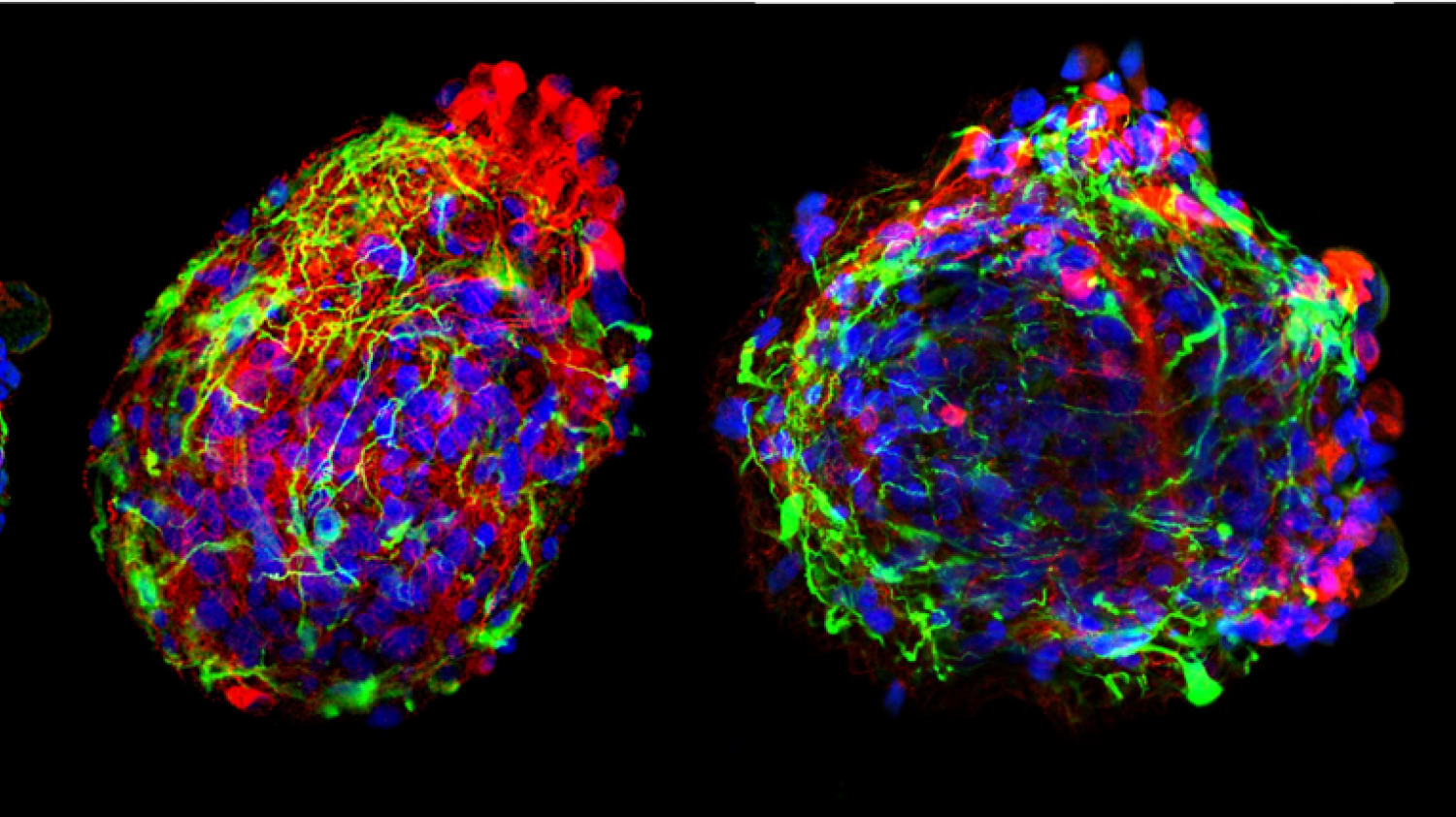
Menschliche „Minigehirne “ für die Zelltodforschung. Die Farben zeigen die verschiedenen Zelltypen in den Organoiden
In der entsprechenden Spitzenforschung ist es unter dem Stichwort „Organ-on-a-chip“ bzw. „Human-on-a-chip“ bereits gelungen, bis zu zehn verschiedene künstlich erzeugte Gewebe zusammenzuschalten, um kleine, tatsächlich atmende Lungen und andere Organoide zu funktionellen komplexen Einheiten zu verbinden. Einzeln und im Zusammenspiel ermöglichen diese künstlichen Organstrukturen aufgrund ihrer Nähe zum menschlichen Körper die viel gezieltere Erforschung von toxischen Effekten und den Vorgängen, die diese in der Zelle auslösen. Über CAAT-Europe sind die Konstanzer Toxikologen auch an das am 4. Mai 2021 eröffnete BW-3R Netzwerk angeschlossen, das sich vorwiegend der Weiterentwicklung der Organ-on-a-Chip Technologie widmet.
Weiterlesen: Risiken abschätzen und minimieren (Kapitel 9 von 10)
Zurück zur Artikelreihe
Tullia Giersberg
Verwandte Artikel: